Fuerte advertencia de terapistas para limitar su uso. Cruces en la comunidad científica sobre lo que podría ser una alternativa terapéutica útil en el tratamiento de cuadros moderados a graves de coronavirus desarrollada en el país.
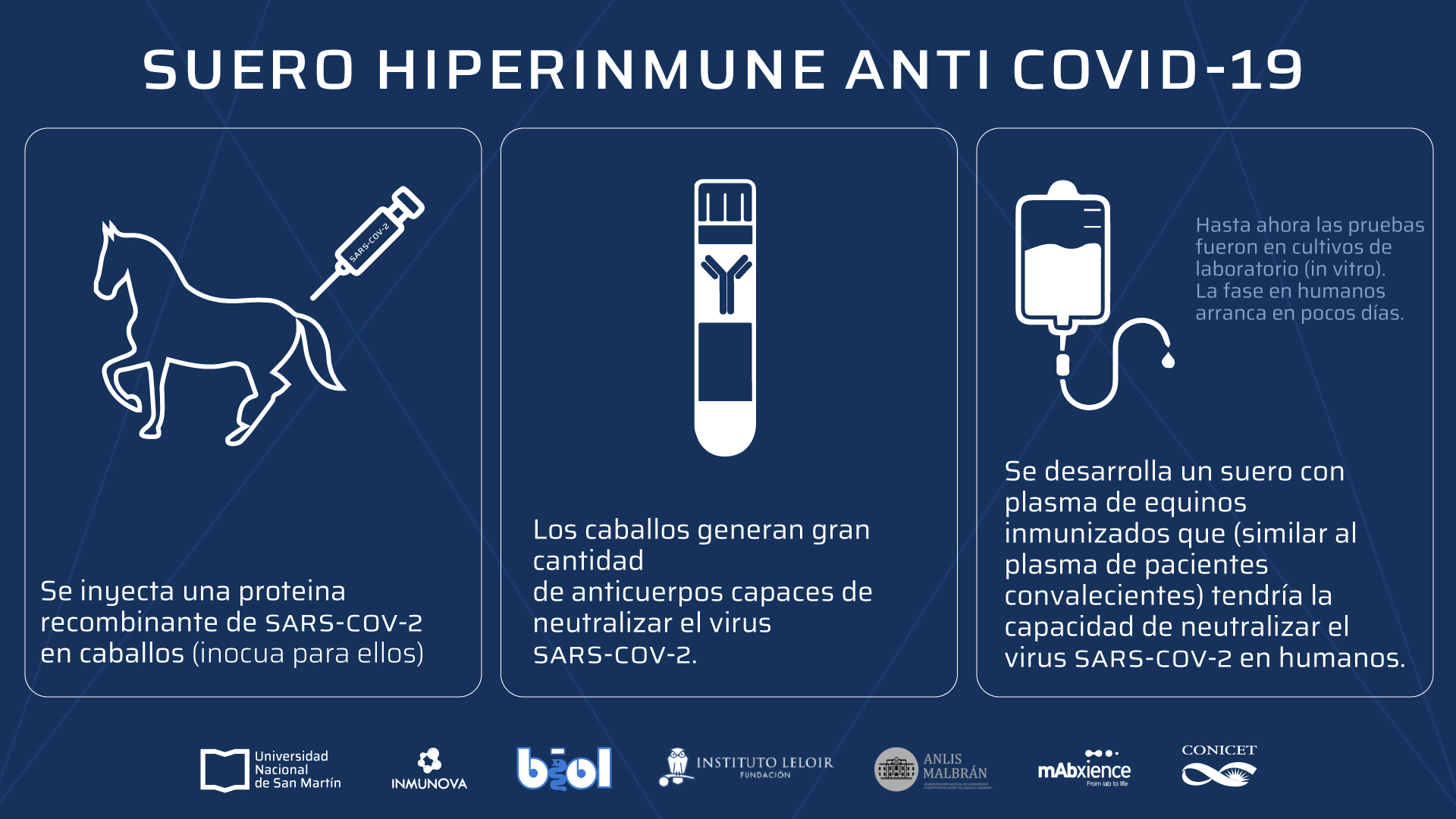
El presidente Alberto Fernández había recorrido hace exactamente una semana atrás las instalaciones de la compañía biotecnológica Inmunova, en el campus de la Universidad Nacional de San Martín, que desarrolló junto a otros centros científicos públicos y privados el suero hiperinmune anti Covid-19, que será distribuido en hospitales, clínicas y sanatorios. El mandatario había expresado su orgullo por los desarrollos alcanzados por la ciencia argentina.
Pero ayer, domingo, la Sociedad Argentina de Terapia Intensiva (SATI) publicó un comunicado en el que «recomienda fuertemente no utilizar suero equino hiperinmune (SEH) en los pacientes internados en terapia intensiva, en los pacientes que requieren asistencia respiratoria mecánica y en los pacientes que hayan recibido plasma de convalecientes para Covid-19.
La advertencia dio inicio a un importante debate, debido a que después de varios meses de investigación, el suero equino hiperinmune CoviFab elaborado por científicos argentinos había sido aprobado a fines de diciembre por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) bajo registro de condiciones especiales para pacientes adultos moderados y severos por Covid-19 y para su uso de emergencia. Este suero anti-Covid-19 es el primer medicamento innovador para el tratamiento de la infección por el nuevo coronavirus totalmente desarrollado en Argentina.
La empresa de biotecnología Inmunova precisó ayer, domingo, que el estudio clínico del suero hiperinmune CoviFab, aprobado por la Anmat para el tratamiento del coronavirus, fue realizado en pacientes con Covid «moderada o severa», pero no en pacientes que requerían «asistencia respiratoria mecánica o que estaban internados en UTI «, por lo que su eficacia» no ha sido estudiada en esta población de pacientes «.
«El estudio clínico de Fase 2/3 que evaluó la seguridad y eficacia del suero hiperinmune anti-SARS-CoV-2 fue un ensayo randomizado, doble ciego, controlado con placebo realizado en 242 pacientes con enfermedad Covid-19 moderada a severa, dentro de 10 días del inicio de síntomas y que requerían hospitalización «, detalló.
«No incluyó (fue un criterio de exclusión) pacientes que requerían asistencia respiratoria mecánica o que se encontraban internados en UTI. Por tanto su eficacia no ha sido estudiada en esta población de pacientes», agrega la información de la empresa biotecnológica.
La aclaración de Inmunova surge tras una recomendación de la Sociedad Argentina de Terapia Intensiva (Sati) de no utilizar el suero equino hiperinmune en pacientes que requieran asistencia respiratoria mecánica o estén internados en terapia intensiva y los que hayan recibido tratamiento con plasma de convalecientes para Covid -19.
«El medicamento demostró un perfil de seguridad positivo, no se registraron eventos adversos serios relacionados con su aplicación y en ningún caso que interrumpió el tratamiento», agregó Inmunova, que participó en el desarrollo en una articulación público-privada que incluyó al Instituto Biológico Argentino (BIOL), con la colaboración de la Fundación Instituto Leloir (FIL), mAbxience, Conicet, la Universidad Nacional de San Martín (Unsam) y el Instituto Malbrán.
«El objetivo primario del estudio, definido en el protocolo de la investigación aprobada por Anmat, fue la mejoría clínica de 2 puntos en la escala ordinal de evaluación clínica de 8 puntos de la OMS a los 28 días del ingreso en el protocolo», abundó Inmunova.»Los datos y resultados del estudio clínico de Fase 2/3 han sido enviados a la comunidad médica y científica y están siendo enviados a una publicación a una revista científica internacional para su evaluación por pares», concluye Inmunova.
La Anmat aprobó el uso del suero equino hiperinmune para el tratamiento del coronavirus el 22 de diciembre pasado, mediante el Registro para Especiales, para pacientes adultos moderados y severos por Covid-19 y para su uso de emergencia.
La Sociedad Argentina de Terapia Intensiva (Sati) recomendó el sábado no utilizar el suero equinohiperinmune (SEH) para el tratamiento de pacientes que requieran asistencia respiratoria mecánica o estuvieron internados en terapia intensiva y los que hayan recibido tratamiento con plasma de convalecientes para Covid-19.
«Recientemente se presentó los resultados del estudio aleatorizado doble ciego de SEH. Entre los principales criterios de exclusión de los pacientes que requirieron asistencia respiratoria mecánica (ARM) o estuvieran internados en Terapia Intensiva (TI), y los pacientes que recibieron tratamiento con plasma de convalecientes de Covid 19 «sostuvo SATI.
«De acuerdo a los datos enviados, no se demostraron los objetivos primarios y secundarios de eficacia clínica en ningún caso, no encontrándose diferencias significativas entre los pacientes que recibieron el SEH y los que recibieron placebo, en relación al ingreso a TI, requerimiento de ARM , y de mortalidad «, expuso.
Y concluyó: «Debido a los resultados enviados en este estudio fase 2/3, la SATI recomienda no utilizar SEH en los pacientes internados en TI; en los pacientes que requieren ARM y en los pacientes que han recibido plasma de convalecientes para Covid-19».